Het sommetje van Rouvoet
Onder de kop “Medicijnindustrie vraagt te veel” schrijft André Rouvoet in
het Nederlands Dagblad (30 juni 2017) over het dure geneesmiddel Orkambi tegen
cystische fibrose (CF), in Nederland ook wel aangeduid als taaislijmziekte.
De minister heeft onlangs besloten dat dit middel niet vergoed zal worden
vanwege de hoge kosten van ongeveer 170.000 euro per patiënt per jaar.
Rouvoet schrijft: “Volgens de fabrikant is de huidige prijs gerechtvaardigd
gezien de hoge ontwikkelkosten. Maar is dit wel echt zo?” Om die vraag te
beantwoorden maakt hij wat hijzelf omschrijft als een ‘sommetje op de
achterkant van een sigarendoos’. Volgens dit sommetje zou het middel maar
3.333 per patiënt per jaar mogen kosten. Hij concludeert dan ook dat sprake
is van “onverantwoorde prijsstellingen van fabrikanten”.
Echt te hoog?
Die conclusie past helemaal in het gangbare beeld dat de hoge prijzen van
nieuwe geneesmiddelen, niet alleen bij CF maar ook bij kanker en reuma,
veel te hoog zijn. Die hoge prijzen zouden volgens veel critici op geen
enkele manier kunnen worden verklaard uit de hoge ontwikkelingskosten. Maar
is dat ook zo? Het antwoord op die vraag is enorm belangrijk. Want als de
huidige prijzen nodig zijn om de ontwikkelingskosten terug te verdienen,
dan zullen lagere prijzen resulteren in minder onderzoek door
farmaceutische bedrijven naar nieuwe geneesmiddelen tegen CF, kanker en
andere aandoeningen waaraan patiënten voortijdig overlijden. Eén cijfer om
duidelijk te maken dat nieuwe middelen nodig zijn: jaarlijks overlijden
ruim 14.000 Nederlanders voor hun 70e levensjaar aan kanker.
Daarmee is kanker veruit de belangrijkste doodsoorzaak op relatief jonge
leeftijd.
Met zijn sommetje lijkt Rouvoet de critici gelijk te geven. Volgens zijn
berekeningen is de prijs maar liefst 40 maal zo hoog als nodig is om de
ontwikkelingskosten terug te verdienen. Maar het sommetje van Rouvoet is
helaas onvolledig en gebaseerd op onrealistische aannames. Een completer en
realistischer sommetje, nog steeds op de achterkant van een sigarendoos,
komt tot een prijs van tenminste 20 000 euro en waarschijnlijk nog veel
hoger.
Welke aannames maakt Rouvoet?
Maar eerst het sommetje van Rouvoet. Zijn startpunt is de aanname (zonder
verdere onderbouwing) dat de ontwikkelingskosten 2,5 miljard euro zijn, een
bedrag dat spoort met gangbare schattingen in de literatuur. [1] De verliezen in het
verleden van Vertex, het bedrijf dat Orkambi heeft ontwikkeld, maken
duidelijk dat er inderdaad miljarden terugverdiend moeten worden met
Orkambi om die verliezen goed te maken. Vertex maakt nog één ander
geneesmiddel, Kalydeco, ook voor patiënten met CF maar voor een genetische
variant die maar bij vijf procent van de patiënten voorkomt.
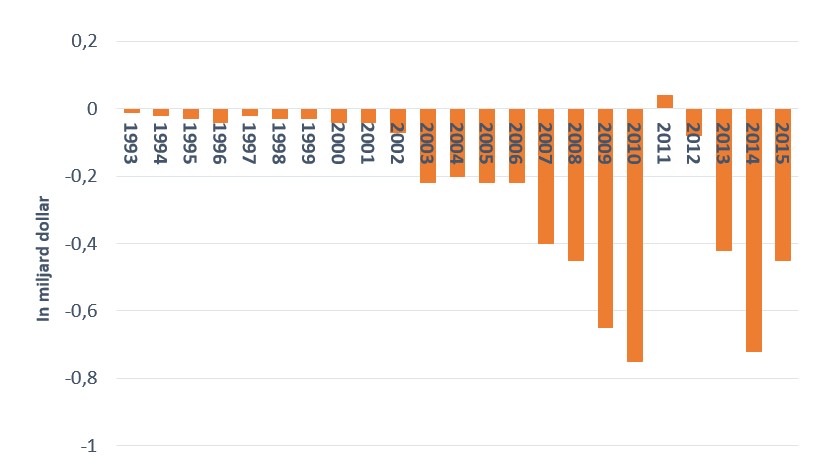
Onderstaande figuur 1 bevat het nettoresultaat voor de periode 1993-2015 van
Vertex. Het bedrijf heeft in die periode slechts één keer winst gemaakt. De
contante waarde in 2016 van deze stroom verliezen is, bij een
discontopercentage van 8 procent, ruim 9 miljard dollar. Daar staan tot
dusverre dus slechts twee geneesmiddelen tegenover die het bedrijf geld
opleveren.
Figuur 1: winst/verliescijfers van het farmaceutische bedrijf Vertex, 1993-2015 (in miljarden dollars)
Bron:
Bloomberg
Rouvoet stelt dat Nederland 1 procent moet bijdragen aan de
ontwikkelingskosten van een nieuw geneesmiddel. Hij baseert deze aanname op
het Nederlandse aandeel in de mondiale geneesmiddelenmarkt. Nederland is
goed voor ongeveer 1 procent van de wereldmarkt voor geneesmiddelen en 1
procent van 2,5 miljard euro is 25 miljoen euro. Dit bedrag zou volgens
Rouvoet in 10 jaar moeten worden terugverdiend, omdat daarna het patent
afloopt. 25 gedeeld door 10 levert een bedrag van 2,5 miljoen per jaar. Als
je dit bedrag deelt door de 750, het aantal patiënten in Nederland dat
volgens het Zorginstituut baat heeft bij het middel, dan kom je inderdaad
op het bedrag van Rouvoet: 3.333 euro.
Wat gaat er mis in de som van Rouvoet?
Is dit inderdaad een redelijke prijs voor Orkambi? Helaas niet, want er
gaat van alles mis in dit sommetje. Allereerst de 1 procent die Nederland
zou moeten bijdragen aan de ontwikkelingskosten. Het mondiale marktaandeel
waar Rouvoet dit percentage op baseert geldt voor alle geneesmiddelen bij
elkaar, duur en goedkoop. In armere landen worden duurdere geneesmiddelen
veel minder vaak vergoed en dus veel minder vaak gebruikt dan in rijkere
landen. Het Nederlandse marktaandeel is bij dure geneesmiddelen dus groter
dan 1 procent. Zo is het Nederlandse aandeel van de wereldmarkt voor
TNF-remmers, reumamiddelen met een prijskaartje van 15.000 euro per patiënt
per jaar, ongeveer 3 procent.
Bovendien is CF een aandoening die vooral de bevolking van Noord-West
Europa en hun afstammelingen in Noord-Amerika treft. Daar komt nog bij dat
Orkambi alleen werkt bij een bepaalde genetische variant van CF. Iets
minder dan de helft van alle CF patiënten heeft deze variant. Volgens de
producent zelf zijn er 20.500 patiënten in de VS en de Europese Unie die
baat hebben bij het middel (zie
Vertex Outlines 2016
). Daar komen nog een paar duizend patiënten bij in Canada en Australië en
andere Europese landen. In totaal hebben dan maximaal 30.000 CF patiënten
baat bij Orkambi, waarvan 750 in Nederland. Daarmee is het aandeel van
Nederland in de totale patiëntenpopulatie 2,5 procent in plaats van de 1
procent waar Rouvoet mee rekent. Dat is een eerste correctie op zijn
sommetje, waardoor de acceptabele prijs stijgt tot 8.333 euro.
Maar dan zijn we er nog niet
Als het bedrijf in 10 jaar tijd de investering in ontwikkelingskosten
terugverdient, dan eisen beleggers een vergoeding voor het feit dat ze
zolang moeten wachten. Ze hadden hun geld immers ook elders kunnen beleggen
tegen een bepaald verwacht rendement. Dit vereiste rendement is volgens
experts op zijn minst 8 procent per jaar. [2] Om 2,5 miljard dollar
terug te verdienen, inclusief de vergoeding voor het wachten, moet het
bedrijf jaarlijks 400 miljoen dollar verdienen in plaats van 250 miljoen.
2,5 procent hiervan is 10 miljoen. Per patiënt is dit 13.333 euro in plaats van de
eerder berekende 8.333.
En daarmee zijn we er nog steeds niet. Rouvoet vergeet dat de prijs van Orkambi niet alleen dient ter dekking van
de ontwikkelingskosten. De producent maakt ook allerlei andere kosten,
waaronder kosten van voor productie, distributie en marketing. Deze kosten
bedragen volgens de jaarverslagen van Vertex in 2015 en 2016 zo’n 600 miljoen euro
per jaar (ook andere critici vergeten dit wel eens, zie Yu et al., 2016) Als we de
helft van de kosten toerekenen aan Orkambi, dan is dit een kostenpost van
300 miljoen euro per jaar. Als we hiervan opnieuw 2,5 procent toerekenen aan
Nederland komen we op 7,5 miljoen euro per jaar. Per patiënt 10.000 euro.
Dat is inderdaad een fors bedrag om een paar pillen bij de patiënt te
krijgen, maar dat is nog geen reden om te doen alsof deze kosten niet
worden gemaakt. Opgeteld bij het eerder berekende bedrag van 13.333 euro
staat de teller dan al op ruim 20 duizend euro. Dit is om allerlei redenen nog maar een ondergrens:
-
Het middel werkt bij lang niet alle patiënten goed, zelfs niet als zij
de genetische variant hebben waar het middel op aangrijpt. Een deel van de
patiënten die beginnen met het middel zal er daarna weer mee stoppen.
Analisten van Credit Suisse gaan ervan uit dat van alle kinderen tussen de
6 en 11 jaar die in 2017 met het middel beginnen, 20 procent er weer mee zal
stoppen. Een
andere analist schreef in 2016: “Vertex Pharmaceuticals’ Orkambi (lumacaftor/ivacaftor) for cystic
fibrosis (CF) has generated lacklustre physician reviews since its July
2015 US launch. They noted lung function (FEV1) improvements were mediocre
and inconsistent in patients, and tolerability issues could spur more
discontinuations than expected.”
-
In het verlengde hiervan is er een reële kans dat er de komende jaren
betere middelen op de markt komen, waardoor Orkambi niet meer wordt
voorgeschreven. Een aantal bedrijven , waaronder Vertex zelf, heeft
producten in de pijplijn in fase 2 en 3 gericht op CF, ook voor patiënten met de genetische variant waar Orkambi op aangrijpt.
Het aantal jaren waarin de ontwikkelingskosten van Orkambi moeten worden
terugverdiend is dan geen 10 jaar maar minder.
-
Het bedrag aan niet-onderzoekskosten is waarschijnlijk veel hoger dan de
300 miljoen waarmee ik heb gerekend. De marktintroductie in Europa vereist
het optuigen van een marketingapparaat en het doorlopen van kostbare
toelatingsprocedures. Die kosten zijn nog niet zichtbaar in de
jaarverslagen van 2015 en 2016. Ook het feit dat onderzoek en ontwikkeling
op dit moment 60 tot 70 procent van de totale kosten uitmaken van Vertex,
wijst erop dit het bedrijf de transitie aan het doormaken is van
pre-commercieel (alleen onderzoek en ontwikkeling) naar commercieel (ook
verkoop). Na deze transitie zullen de overige kosten een veel groter deel
van de kosten uitmaken. Bij grote farmabedrijven maken de onderzoek- en
ontwikkelingskosten ongeveer 15 tot 20 procent deel uit van de kosten. [3]
-
Niet alle potentiële gebruikers van Orkambi zijn verzekerd. In de VS
stelt Vertex het middel gratis ter beschikking aan onverzekerde patiënten.
Als we met deze factoren rekening houden stijgt de kostendekkende prijs
verder. En dan treedt er een soort domino-effect op. Bij die hogere prijs
neemt het aantal potentiële gebruikers verder af. Armere Europese landen
vinden een prijs van 20 duizend euro waarschijnlijk al te hoog, maar als de
minimale prijs die nodig is om alle noodzakelijke kosten te dekken
aanzienlijk is dan 20.000 euro haken ook landen als Engeland af en moeten
de kosten worden terugverdiend over een nog kleinere groep patiënten.
We kunnen ook langs een andere route nagaan of het prijsbeleid van Vertex
valt te verklaren uit de kosten. Als we de eerder berekende contante waarde
van de verliezen uit het verleden als uitgangspunt nemen, dus zo’n negen
miljard euro, dan mag de contante waarde van de operationele winst gelijk
zijn aan negen miljard euro. Een acceptabele prijs is die prijs waarbij de
contante waarde van de toekomstige winsten uit de twee geneesmiddelen van
Vertex gelijk is aan negen miljard euro. Als we uitgaan van een
prijs-kostenmarge van 20 procent, een discontovoet van 8 procent en een periode
van 10 jaar dan moet de jaarlijkse omzet aan geneesmiddelen zeven miljard
dollar zijn. Bij 40.000 patiënten (gecombineerd aantal potentiële
gebruikers van de twee geneesmiddelen die Vertex op de markt heeft
gebracht) komen we op een prijs van ruim 175 000 dollar per patiënt per
jaar. Bij een hogere prijs-kostenmarge is het bedrag natuurlijk lager. Bij
een lager aantal betalende patiënten of een kortere effectieve
terugverdientijd is het bedrag hoger. Maar hoe dan ook is het bedrag
tenminste een orde van grootte hoger dan het sommetje van Rouvoet.
Andere dure geneesmiddelen
Voor Orkambi lijkt de conclusie dus duidelijk: de acceptabele prijs voor
het middel is vele malen hoger dan volgt uit het sommetje van Rouvoet. Het
zou best eens kunnen dat de verliezen in de afgelopen 20 jaar de enorm hoge
prijs rechtvaardigen.
Nu kun je tegenwerpen dat het voorbeeld van Rouvoet ongelukkig is gekozen,
en dat over het algemeen de winsten van farmaceutische bedrijven
buitensporig hoog zijn. Dat is in ieder geval wat de demissionaire minister
van Volksgezondheid Schippers in een interview in Medisch Contact
(22 september 2016) betoogt: “De geneesmiddelensector maakt vergeleken met
andere industrieën schrikbarend hoge winsten.” Of een artikel in
de Volkskrant (2 januari 2016)
: “Over de jaarlijkse winsten - 20 procent van het geïnvesteerd vermogen -
is men zonneklaar: die zijn niet te begrijpen. Ook niet vanwege het
marktrisico. Want dat is laag. Ook dit risico kan de hoge winstgevendheid
niet verklaren.” De journalist die dit schreef baseert zich op een rapport
van het gerenommeerde Amsterdamse onderzoeksbureau SEO (Kok, en Van der Voort, 2014). Een winst van 20
procent van het geïnvesteerde vermogen is inderdaad veel hoger dan in
andere bedrijfstakken.[4]
Onderzoek van accountantskantoor Deloitte komt tot een hele andere
conclusie. Deloitte volgt sinds 2010 een groep van 12 grote farmabedrijven
om de winstgevendheid van geneesmiddelenonderzoek in kaart te brengen. [5] In het meest recente
rapport, uit 2016, concluderen zij dat de 'internal rate of return' op
R&D is gedaald van 10.1 procent in 2010 tot 3,7 in 2016 (Deloitte,
2016). Dit is veel lager dan het rendement dat aandeelhouders eisen op
beleggingen in farmabedrijven. Dat ligt tussen de 8 en 11 procent, zoals
zojuist vermeld.
Hoe valt dit beeld van Deloitte, dat juist wijst op te lage winsten op
nieuwe geneesmiddelen, te rijmen met het cijfer van 20 procent rendement op
het geïnvesteerde vermogen? Allereerst gaat die 20 procent over alle
geneesmiddelen die nog op de markt zijn. Dat zegt niets over de
winstgevendheid van geneesmiddelen die pas de afgelopen jaren op de markt
zijn gekomen en waar de discussie nu over gaat. Je zou misschien verwachten
dat dure nieuwe geneesmiddelen de winsten van farmaceuten een flinke impuls
moeten hebben gegeven. Dat blijkt echter niet zo te zijn. Hoge prijzen
vormen geen garantie voor hoge winstgevendheid want de ontwikkelingskosten
kunnen zijn gestegen en het aantal patiënten dat deze nieuwe geneesmiddelen
gebruikt is veel kleiner dan bij de blockbusters die in het verleden die
winst van farmabedrijven bepaalden (zie Trusheim en Berndt, 2016).
Bovendien is er een probleem met de boekhoudkundige winst van innovatieve
bedrijven. Bij bedrijven die veel uitgeven aan onderzoek is het
geïnvesteerde vermogen vaak veel hoger dan wat in de jaarverslagen staat.
Dat komt doordat het geïnvesteerde vermogen in de jaarverslagen geen
rekening houdt met investeringen in onderzoek- en ontwikkeling (O&O).
Volgens de Amerikaanse boekhoudregels moeten bedrijven uitgaven aan O&O
boeken als kosten in het jaar waarin de uitgaven zijn gedaan. In
werkelijkheid zijn onderzoekuitgaven natuurlijk investeringen die pas in de
toekomst (hopelijk) bijdragen aan de winst. Door onderzoekuitgaven te
boeken als kosten en niet als investeringen is het geïnvesteerde kapitaal
dat in de boeken staat lager dan het in werkelijkheid is. [6] Met als gevolg een
onderschatting van de werkelijke winst per euro kapitaal. [7] In een bekend handboek
voor de waardering van bedrijven (Koller et al. 2016), staat hierover het
volgende:
“When a company builds a plant or purchases equipment, it capitalizes the
asset on the balance sheet and depreciates it over time. Conversely, when a
company invests in intangible assets such as a new production technology, a
brand name, or a distribution network, the entire outlay must be expensed
immediately. In sectors such as pharmaceuticals, high technology, and
branded consumer goods, failure to recognize such expenses as investments
can lead to significantly underestimating a company’s invested capital and
overstating its return on invested capital.” (p. 456)
Aan de hand van een cijfervoorbeeld voor een denkbeeldig farmabedrijf laten
de auteurs zien dat dit veel kan uitmaken. De winst als percentage van het
geïnvesteerde kapitaal volgens de standaardmethode is in hun voorbeeld 33
procent. Na correctie voor investeringen in onderzoek en ontwikkeling daalt
de winst tot 9,5 procent van het geïnvesteerde kapitaal.
Perspectief telt
De conclusie is duidelijk. Als je vanuit het perspectief van beleggers naar
de winstgevendheid van nieuwe geneesmiddelen kijkt, dan waren de winsten de
laatste jaren waarschijnlijk niet hoog genoeg om aan de rendementseis van
beleggers te voldoen. Geneesmiddelenonderzoek zou helaas wel eens veel
minder winstgevend kunnen zijn dan vaak wordt gedacht. Helaas, want als de
winsten van farmaceuten wel excessief zijn dan zou je lagere prijzen kunnen
afdwingen zonder daarmee de innovatieprikkel al te sterk te ondermijnen.
Als de winstgevendheid van nieuwe geneesmiddelen - ondanks hoge prijzen –
al laag is, dan is er een pijnlijk dilemma tussen lage prijzen nu en nieuwe
geneesmiddelen in de toekomst. Meer van het één betekent dan minder van het
ander. Ingrijpen in de prijzen van nieuwe geneesmiddelen zal deze
winstgevendheid verder aantasten. Alleen als het mogelijk is de kosten van
geneesmiddelenonderzoek fors te verlagen kunnen de prijzen omlaag zonder de
winst verder aan te tasten.
Disclosure statement: ik houd af en toe een betaalde lezing voor een
farmaceutisch bedrijf en ik heb een paar jaar geleden een rapport
geschreven voor Nefarma over de werk-gerelateerde baten van nieuwe
geneesmiddelen.
Voetnoten:
[1]
Zie Schuhmacher et al. (2016). Tabel 5.1 in dit boek bevat een
overzicht van studies naar de gemiddelde ontwikkelingskosten van
een nieuwe geneesmiddel. De schattingen variëren van 1,2 tot 2,9
miljard dollar. Critici van de farmaceutische industrie beweren
vaak dat de ontwikkelingskosten veel lager zijn, maar baseren zich
op onrealistische aannames zoals de aanname dat de kapitaalkosten
nul zijn. In de schattingen samengevat in Schumacher et al. (2016)
zijn de kapitaalkosten goed voor bijna de helft van de
ontwikkelingskosten.
[2]
Voor de periode 2001-2008 komt Harrington (2012) op zo’n 9% voor
grote farmaceutische bedrijven en 12 tot 13 procent voor
biotechnologiebedrijven. Koijen eet al. (2016) gaan in op een
mogelijke verklaring voor de hogere kaptaalkosten in de
farmaceutische industrie in vergelijking met andere bedrijfstakken,
namelijk politiek risico. Hiermee bedoelen zij het risico kans dat
de overheid ingrijpt in prijzen en vergoedingslimieten.
[3]
Volgens sommige critici van de farmaceutische industrie zijn de
overige kosten vooral marketingkosten. Zij concluderen hier
doorgaans uit dat dit verspilling is. Maar hoe aannemelijk is het
dat bedrijven enorme bedragen uitgeven aan marketing als ze niet
verwachten dat dit bijdraagt aan het bedrijfsresultaat? Bovendien
bevat de post die doorgaans wordt aangeduid als marketing maar in
de Angelsaksische wereld als SG&A (sales, general, and
administrative) ook de kosten van management en
toelatingsprocedures. Het aandeel van SG&A is bij bedrijven als
Apple, Microsoft en IBM en GE nog een stuk hoger dan in de
farmaceutische industrie. Zie Derek Lowe, But Don’t Drug Companies
Spend More on Marketing? 20 mei 2013.
[4]
Het SEO-onderzoek keek naar de winstcijfers van de 10 grootste
bedrijven gezet voor het jaar 2012. Het zijn bekende bedrijven: Eli
Lilly & Co , Bristol-Myers Squibb, Pfizer, Sanofi-Aventis,
Novartis, GlaxoSmithKline, Roche, AstraZeneca, Merck&Co,
Johnson&Johnson. Het meest winstgevend was Pfizer (25%), het
minst winstgevend Roche (14%)..
[5]
De volgende bedrijven zijn meegenomen: Amgen, AstraZeneca,
Bristol-Myers Squibb, Eli Lilly, GlaxoSmithKline, Johnson &
Johnson, Merck & Co., Novartis, Pfizer, Roche, Sanofi en
Takeda.
[6]
Dat de boekhoudkundige winst misleidend is als maatstaf voor de
echte winst van farmaceutische bedrijven is ook al eens uitgebreid
uiteengezet in een medisch tijdschrift door Skrepnek (2004):
“Because the summary measures of profit that appear frequently in
the financial and lay press are accounting based, policy makers and
researchers must he aware of the limitations of using these data
for purposes of comparison or ascertainment of the presence of
supranormal profits or monopoly power.
[7]
Weliswaar lijken ook de kosten hoger dan ze in werkelijkheid zijn
(investering worden immers geboekt als kosten). Dit leidt op
zichzelf tot een onderschatting van de werkelijk winst per euro
geïnvesteerde kapitaal. Bij een lange vertraging tussen investering
en opbrengst domineert het eerste effect.
Referenties:
Credit Suisse, 2016, Equity Research Biotechnology US Large Cap
Biotechnology, 20 December 2016
Deloitte Centre for Health Solutions, 2016, Measuring the return frompharmaceutical innovation,Deloitte.
Goncharov, I., J. Mahlich, en B.B. Yurtoglu, 2014, "R&D investments,profitability and regulation of the pharmaceutical industry." Available at
SSRN 2531467 (2014
Harrington, S.E., 2012, "Cost of Capital for Pharmaceutical, Biotechnology, andMedical Device Firms"
The Oxford Handbook of the Economics of the Biopharmaceutical Industry, Oxford University Press. Oxford.
Koijen, R.S.J., T.J. Philipson, and H. Uhlig. 2016, "Financial health economics." Econometrica 84.1: 195-242.
Kok, L. en J. van der Voort , 2014, De farmaceutische industrie in het maatschappelijk debat. no. 2014-2 2, SEO Economisch Onderzoek, Amsterdam.
Koller, T., M. Goedhart en D. Wessels, 2015, Valuation: Measuring And
Managing The Value Of Companies Sixth Edition McKinsey & Company Wiley.
Schuhmacher, A., M. Hinder en O. Gassmann, 2016,
Value Creation in the Pharmaceutical Industry: The Critical Path to
Innovation, John WIley & Sons.
Skrepnek, G.H, 2004, "Accounting-versus economic-based rates of return:Implications for profitability measures in the pharmaceutical industry."
Clinical therapeutics 26.1: 155-174.
Trusheim, M.R. en Berndt, E.R., 2012, “The Segmentation of TherapeuticPopulations in Oncology”, Health Management, Policy and Innovation, 1 (1):
19-34:
Yu, N., Z. Helms, en P. Bach, 2017, R&D Costs For PharmaceuticalCompanies Do Not Explain Elevated US Drug Prices, Health Affairs blog.
March 7, 2017